【文章导读】
一、院校及专业介绍
二、学费奖学金情况
三、分数线及招生人数
四、考试科目介绍及参考书目
五、23年拟录取名单
六、就业介绍
七、考试大纲
八、2023复试细则
一
学院/专业介绍

学校介绍
深圳大学1983年建校,中央、教育部和地方高度重视深圳大学建设,组织北大援建中文、外语类学科,清华援建电子、建筑类学科,人大援建经济、法律类学科,一大批知名学者云集深圳大学。现有广东省省级重点学科15个,其中攀峰重点学科4个,优势重点学科9个,特色重点学科2个。广东省高等教育“冲一流、补短板、强特色”提升计划重点建设学科6个
截止目前,深圳大学各类在校研究生14770人,其中硕士研究生13861人、博士研究生909人。学校与中科院、香港科技大学、香港大学、香港理工大学、香港浸会大学、澳门大学、澳门科技大学、新加坡南洋理工大学、英国诺丁汉大学等港澳及海外高校开展联合培养研究生项目,截止目前,全校已有28个学院和独立科研单位与国内41所、香港及境外29所高校联合招收博士研究生327人,资助港澳地区联合培养博士53人,海外94人,国内180人。硕士学位授权一级学科39个;硕士专业学位授权类别27个。
学院介绍
深圳大学化学与环境工程学院是理工类综合学院,成立于2006年8月,其历史可追溯至1985年建立的深圳大学应用化学系和1995年建立的深圳大学师范学院化学与生物学系,现设有化学系、环境工程系、新能源科学与工程系,拥有化学一级学科博士点,化学工程、环境工程2个专业硕士点,拥有2个省级实验教学示范中心,1个省级工程研究中心,6个市级重点实验室,1个院士工作站,以及7个校级研究中心。
学院拥有一支实力雄厚、教学经验丰富的师资队伍。中国科学院院士1名,中国工程院院士1名,广东省杰出青年科学基金获得者3名,广东特支计划百千万工程青年拔尖人才2名,珠江人才计划青年拔尖人才4名,珠江人才计划创新创业团队2个,深圳市高层次人才44名,深圳市孔雀人才40名,深圳大学“腾讯创始人校友团队”冠名特聘教授1名。专任教师共96人,其中教授26名,副教授40名,助理教授30名;97%具有博士学位,72%具有海外教育经历。
近五年来,学院共承担国家级基金项目111项,省级基金项目70项,市基金133项,经费共计2.2亿元;专任教师获得发明专利授权110项,其中专利产业化转让11项。发表SCI论文近2000篇,出版学术专著7部。获省级自然科学二等奖2项,省级科技进步奖二等奖2项,省级教学成果一等奖1项。
化学工程考研招考专业分析
所属学院:108 化学与环境工程学院
专业名称:085602化学工程
专业拟招收人数(24):136
研究方向:
01 化学工程
51 先进高分子材料产教 融合育人平台
学制:全日制三年
学费:10000/1学年
住宿费:以全日制脱产方式学习的硕士研究生,根据宿舍房源和住宿条件,1200-1500元/人/年。
二
奖助学金
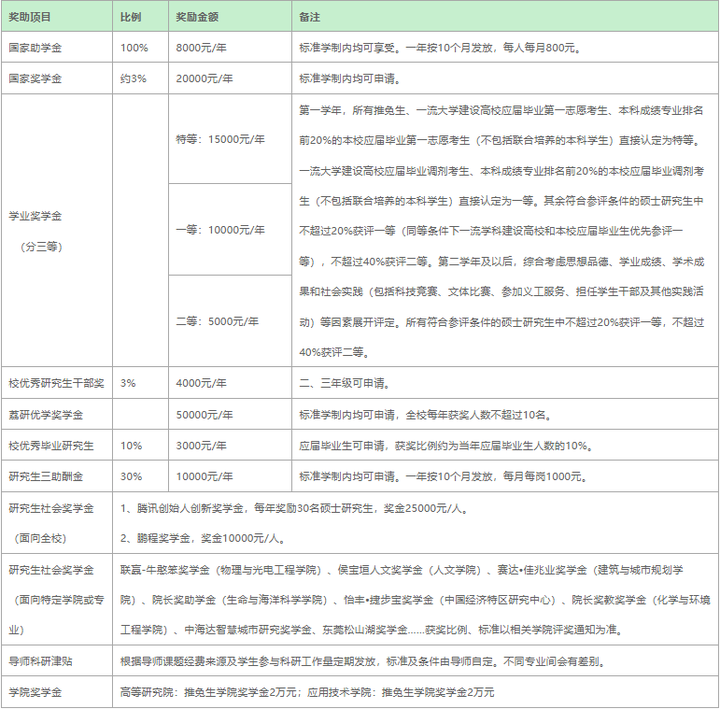
深圳大学依托地区经济发展优势,进一步加大经费投入力度,通过提高待遇水平,吸引优质生源,鼓励学生专心学业。
(1)国家助学金8000元/年;推免生等优质生源可获15000元特等学业奖学金;
(2)在评选国家奖学金、发放国家助学金、设置学业奖学金的基础上,提高了优秀研究生干部奖学金的奖励力度,将荔研优学奖学金提高到5万元;
(3)为了贯彻“大众创业、万众创新”科技精神,鼓励和引导大学生参与科学研究、技术开发、社会实践等创新活动,培养学生崇尚科学、锐意进取的创新、合作精神,充分利用学校人才、科研平台等资源优势,造就一批创新创业人才,学校特设立学生创新创业发展基金。研究生可申报研究生创新项目(一般项目)和重点项目;
(4)设有“鹏程奖学金”、“腾讯创始人创新奖学金”等一批社会(企业)奖学金;
(5)学校通过立项资助研究生科研创新课题、鼓励导师提供科研津贴等形式吸引研究生参与高水平科研项目从而获得资助;
按照我校奖助政策体系,以全日制学习方式的非定向硕士研究生一年获得的奖助学金均不少于8000元,表现优异的将不少于6万元,如累计学校现有国家助学金、荔研优学奖学金、社会(企业)奖学金等,一年所获奖助学金可超过10万元。
奖助学金的具体情况见《深圳大学硕士研究生奖助体系(2024级)》。奖助学金各条款如有变动,以学生部公布的为准。
(四)助学贷款与特困补助
按照国家有关规定,我校可协助经济困难的硕士研究生申请办理国家助学贷款。对于特殊困难学生,学校设有特殊困难补助。
深圳大学硕士研究生奖助体系(2024级)
三
分数线及招生人数
1、往年录取情况
2、国家线、复试线对比
四
考试科目介绍及参考书目
1
考试科目
1、初试考试科目
[101]思想政治理论
[201]英语一
[302]数学二
[914]综合化学
2、复试考试科目
[F108]专业综合知识考核(化学与环境工程学院)
2
参考书目
《分析化学》武汉大学第六版
《无机化学》《无机化学学习指导》天津大学第四版
《无机化学》天津大学 宋天佑主编
五
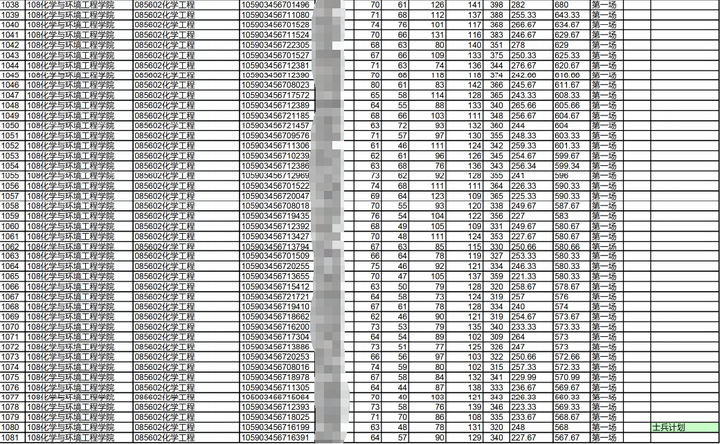
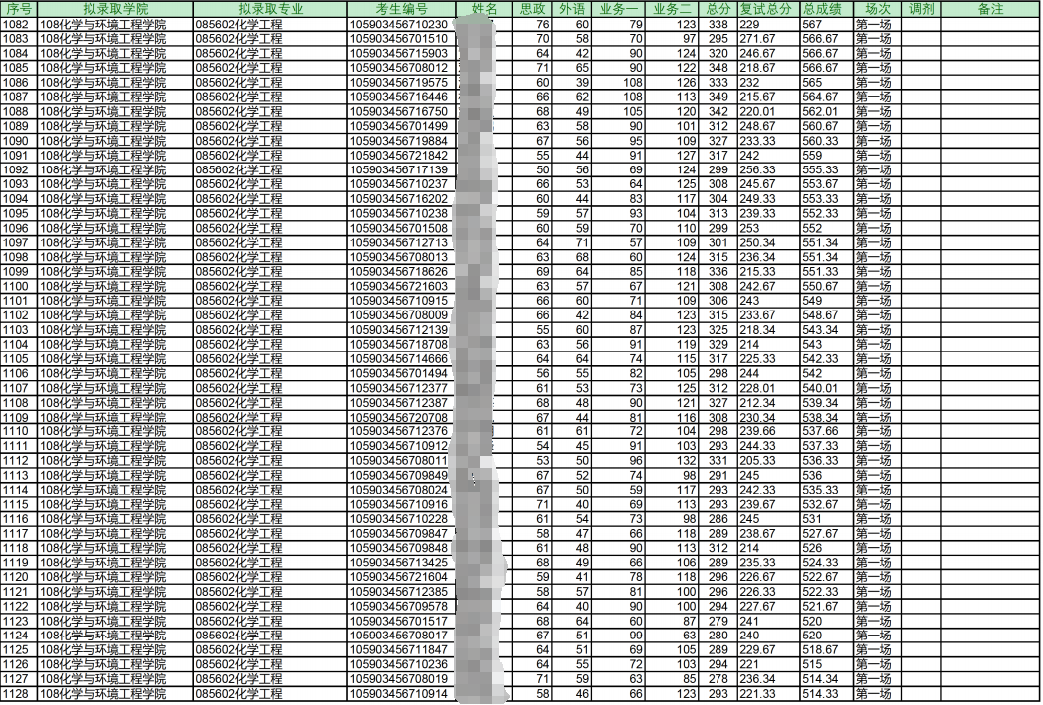
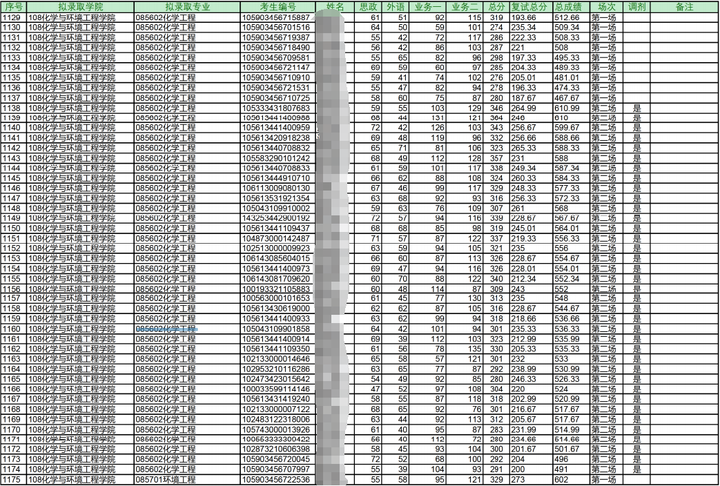
23年拟录取名单
注:最高分398/最低分274
六
就业介绍
1.就业行业包括教育、材料、军工、汽车、军队、电子、信息、环保、市政、建筑、建材、消防、化工、机械等行业。
2.部门包括:各级质量监督与检测部门、科研院所、设计院所、教学单位、生产企业等
七
考试大纲
1
24初试考试大纲
[914]综合化学
一、考试基本要求
本《综合化学》考试大纲适用于报考深圳大学化学工程与技术专业硕士的研究生入学考试。《综合化学》是为招收化学工程与技术专业硕士的研究生设置的具有选拔功能的水平考试。它的主要目的是测试学生对综合化学各项内容的掌握程度。要求学生对综合化学内容有比较系统和全面的了解,了解综合化学的一些基本原理,并能够运用有关基本原理去掌握化学中元素和化合物的基本知识,并具有对一般化学问题进行理论分析和计算的能力。
二、考试内容和考试要求
(一)化学反应中的质量关系和能量关系
1、掌握原子、分子、元素、核素、同位素、原子质量、平均原子质量、分子量、式量等基本概念,了解相似概念间的区别。
2、了解状态函数等热力学基本概念。掌握理想气体状态方程及混合气体分压定律。
3、掌握化学热力学四个最重要的状态函数—热力学能、焓、吉布斯自由能和熵。
4、掌握反应焓、反应熵和反应自由能的计算。
(二)化学反应的方向、速率和限度
1、熟练运用吉布斯自由能变化去判断化学反应的方向,理解化学反应等温式的含义,会用其求算吉布斯自由能变和平衡常数。
2、了解化学反应速率的概念,了解反应机理、基元反应的概念。
3、掌握浓度、温度及催化剂对反应速率的影响,初步了解活化能的概念及其与反应速率的关系。
4、了解化学平衡的概念,理解平衡常数的物理意义,理解各种不同平衡常数的表达式及其相互关系。
5、掌握有关化学平衡的计算,熟悉有关化学平衡移动原理。
(三)原子结构与元素周期性
1、掌握基态原子核外电子排布原理,在给定原子序数时能写出基态原子的核外电子排布,价电子排布。
2、建立元素周期率、周期系、周期表、周期性的基本概念。周期表位置与电子组态的相互确定。
3、掌握电离能、电子亲和能和电负性等概念的物理意义。
(四)物质结构
1、掌握价键理论和杂化轨道理论,能够用杂化轨道理论解释分子的几何构型和相关性质。
2、掌握共价键的性质:包括键长、键角、键能、键和分子的极性等。
3、掌握分子间力的概念,分清化学键和分子间力的区别。掌握氢键的特征和形成条件,以及分子间力和氢键对于物质的物理性质的影响。理解化合物的性质与分子结构间的关系。掌握晶体的类型与物质性质的关系。
(五)重要元素的性质与反应
熟悉并掌握s区、p区、d区和ds区元素的结构、性质、用途以及含该元素化合物之间的相互转化、性质递变规律。
(六)分析化学概论、误差与分析数据处理
1、掌握误差、偏差、有效数字等基本概念;了解误差的产生原因及减免方法;掌握准确度和精密度的表示方法及有关计算;了解有效数字的修约规则及运算规则。
2、了解滴定分析法对化学反应的要求,掌握基准物质的概念和标准溶液的配制与标定等;熟悉滴定分析中的定量计算。
(七)酸碱反应和酸碱滴定
1、掌握溶液酸度、pH值与氢离子浓度的相互关系。
2、能应用化学平衡原理分析水、弱酸、弱碱的解离平衡;熟练掌握影响平衡移动的因素;熟练掌握有关离子浓度的计算。
3、掌握质子理论的酸碱概念;理解溶液中的相关平衡及酸碱组分的分布分数;熟悉酸碱溶液中pH值的计算。
4、了解缓冲溶液的组成;缓冲作用原理;缓冲溶液的性质。掌握缓冲溶液pH值的计算和选择原则。
5、熟悉一元弱酸(碱)滴定过程中溶液pH的变化趋势,酸碱滴定曲线的绘制及pH突跃范围的意义;掌握一元弱酸(碱)准确滴定条件。
6、了解多元酸碱分步滴定和准确滴定的判断及其化学计量点pH的计算。
7、掌握酸碱指示剂的变色原理、变色范围和选择原则;了解滴定误差的计算方法。
(八)沉淀-溶解平衡与沉淀滴定、重量分析法
1、掌握Ksp的意义及溶度积规则。掌握沉淀生成、溶解或转化的条件。
2、熟练掌握有关沉淀-溶解平衡的计算。
3、了解沉淀滴定的基本原理和应用范围。
4、掌握沉淀重量法中沉淀溶解度的计算及其影响因素;掌握重量分析结果的计算;掌握晶型沉淀和无定形沉淀的沉淀条件。
(九)氧化还原反应与氧化还原滴定
1、牢固掌握氧化还原反应的基本概念,掌握氧化还原反应方程式的配平方法。
2、理解标准电极电势的意义,能运用标准电极电势来判断氧化剂和还原剂的强弱、氧化还原反应的方向;能应用电极电势计算反应的平衡常数。
3、掌握用Nernst方程讨论离子浓度、酸度变化时电极电势的改变和对氧化还原反应的影响。
4、掌握氧化还原滴定法的基本原理;了解条件电极电势的概念和影响因素;了解可逆的对称的氧化还原电对在滴定过程中电极电势的确定和滴定曲线的绘制。
5、掌握碘量法、高锰酸钾法、重铬酸钾法等氧化还原滴定法的原理、特点和定量计算等。
(十)配位化合物与配位滴定
1、掌握配合物的基本概念、组成及简单配合物的命名;掌握配合物的化学键理论。
2、了解配合物在水溶液中的稳定性,掌握配位平衡的有关计算。
3、了解EDTA的性质及其与金属离子的络合能力和特点;掌握EDTA滴定的基本原理。
4、了解各种副反应系数的意义和条件稳定常数的计算方法;掌握滴定突跃范围的影响因素和单一金属离子准确滴定的判据。
5、了解金属指示剂指示终点的原理,常用金属指示剂及其使用条件。了解在滴定过程中金属离子浓度的变化趋势和滴定误差的计算。
三、考试基本题型
主要题型可能有:判断题、选择题、填空题、问答题、鉴别题、计算题等。试卷满分为150分。
2
24复试考试大纲
专业综合知识考核,不提供参考书目及考试大纲。
八
2023复试细则
https://chem.szu.edu.cn/info/1243/6031.htm
|